3款干细胞新药IND,茵冠生物跑出“深圳速度”
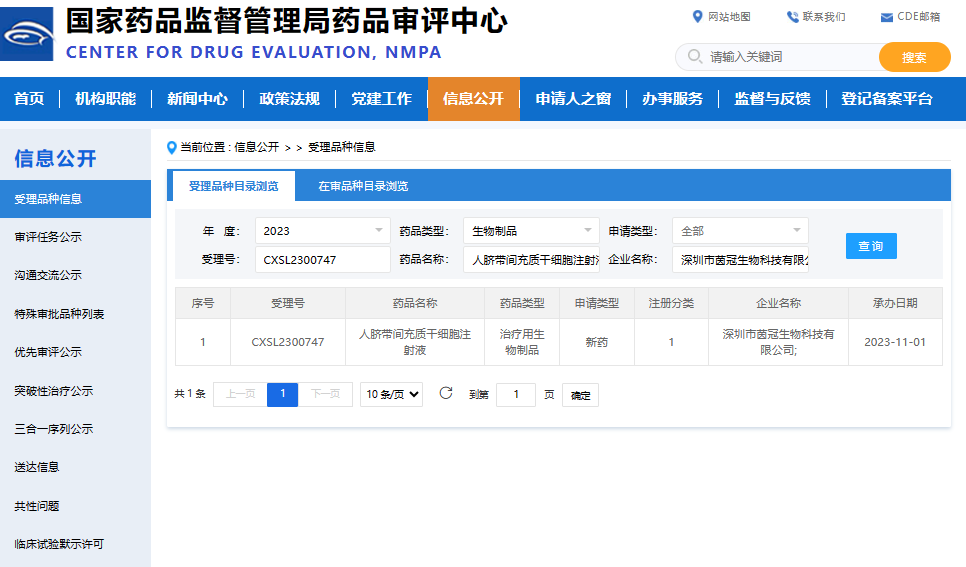
11月1日,据国家药品监督管理局药物审评中心(CDE)官网显示,由光明区企业深圳市茵冠生物科技有限公司自主研发的I类生物制品“人脐带间充质干细胞注射液”的新药临床试验 (IND)申请,已经获得受理(受理号:CXSL2300747)。
作为深圳本土干细胞企业,茵冠生物在干细胞新药研发领域体现出极强的科创实力,短短一个多月内(9月26日-11月1日)接连两款干细胞新药IND获得受理,在新药申报路上跑出了“深圳速度”。截至目前,茵冠生物已有3款干细胞新药IND申请获得受理,其中1款干细胞新药临床获批(适应症:急性缺血性脑卒中),目前正在首都医科大学附属北京天坛医院和深圳市第二人民医院实施Ⅰ/Ⅱa期临床试验。
以科技创新为源头,深圳正加快“20+8”战略性新兴产业集群和未来产业发展,其中,光明区重点布局和发展以生物医药、高端医疗器械、合成生物以及脑科学与类脑智能等为代表的“8+5”产业,精准高效推动生命健康产业集聚发展,打造“生物医药技术创新区”和“未来产业策源地”。
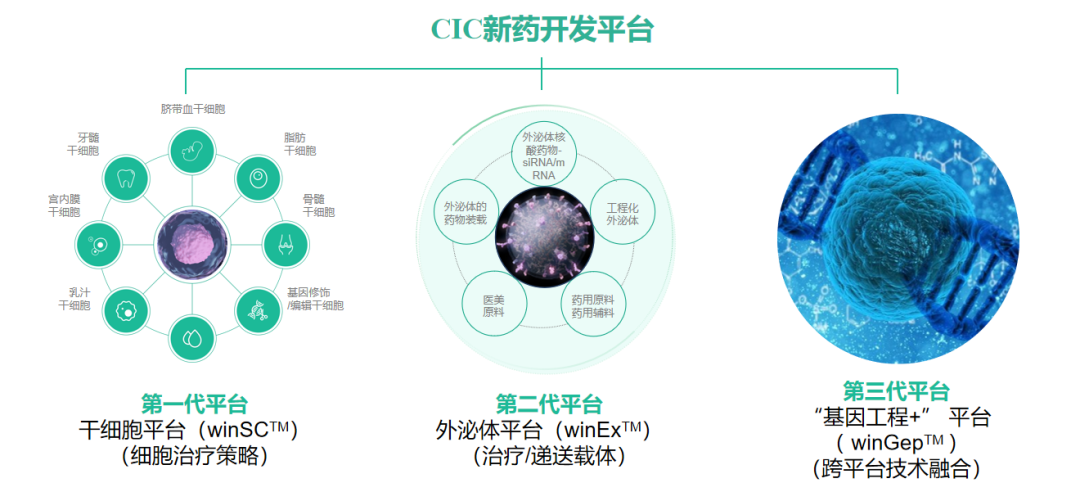
“茵冠生物是2013年在深圳成立的本土生物医药企业,我们的第一个干细胞新药临床试验批件,也是深圳本土的第一个干细胞新药临床试验批件。”茵冠生物常务副总裁李斯霞说:“我们以临床价值为导向,创新开发高确定性的新型生物医药产品,打造了干细胞平台、外泌体平台和“基因工程+”三大技术平台,布局了10余条干细胞药物产品管线,其他技术平台的产品管线也正在源源不断地进行开发和补充。这些产品将通过药物注册上市或通过医疗技术转化的方式实现产业化。除此之外,公司建立了一整套成熟完善的从组织来源采集到生产制备工艺,再到临床项目研究和转化应用的技术平台,最大限度地降低了整个过程的生产成本,未来我们的产品不会是天价产品,我们要让每个患者都能看得起病、用得起药。深圳对生物医药产业的政策支持力度,给了企业很大信心。”
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
























 营业执照公示信息
营业执照公示信息